【48812】医疗器械 英国MHRA发布延伸CE有用期攻略布告
时间: 2024-05-16 12:40:27 | 作者: 爱游戏官方下载
依据欧盟发布MDR过渡延期法令来延伸医疗器械CE证书有用期的布景下(93/42/EEC指令(EU MDD)和90/385/EEC指令(EU AIMDD)),该攻略首要论述了英国MHRA针对该法令内容在英国注册体系 (DORS) 中新器械注册和已注册器械办理的含义。
在该攻略中,英国MHRA已清晰在EU MDD和EU AIMDD颁布的经过满意延伸的欧盟MDR过渡组织(第120条)而延伸有用期的CE证书仍被北爱尔兰(NI)和英国(GB)商场所承受。

MHRA针对CE证书已过期,但契合MDR过渡组织(第 120 条)进行延期的处理办法,假如该医疗器械的CE认证已过期(该证书在2021年5月26日依然有用,并在2023年3月20日之前过期),MHRA将要求制造商上传一份声明信函,以声明其证书延期契合MDR Article 120的要害条件现已满意,即:
b. 假如在到期日前没有签署此类合同,则承认制造商已依据欧盟MDR法规第59条获得了对合格鉴定程序的豁免,或许他们已依据欧盟MDR法规第97条获得了一段时间来进行合格鉴定。

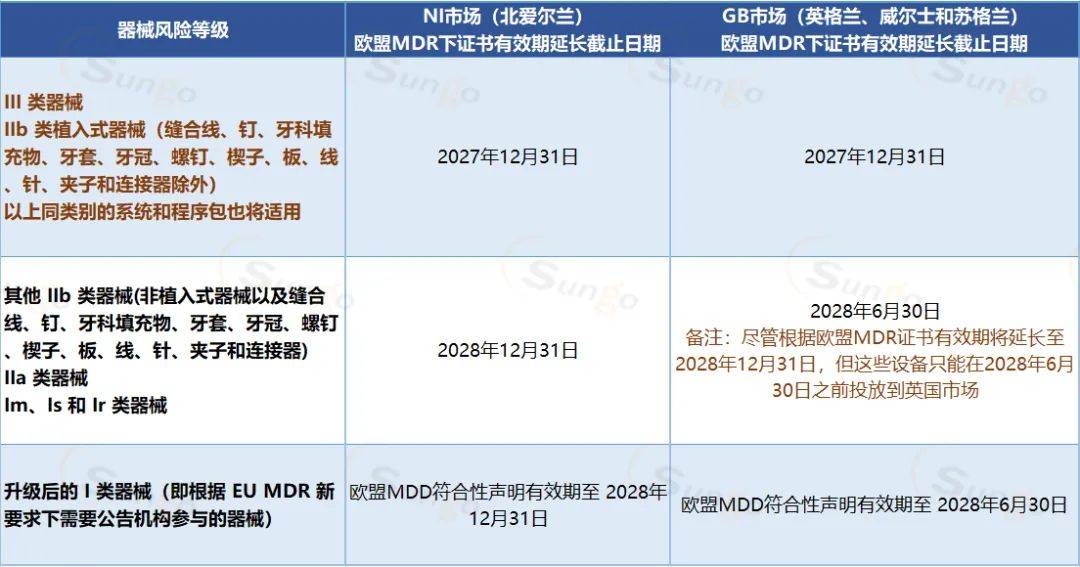
补白:假如器械一起投进GB和NI商场,则有用期延伸到期日期应当遵从较早的到日期。
在此之后持续依靠此类证书独自投进NI商场,到时,体系将需求更新,并仅上传与NI商场投进相关的进一步声明。



